 ⓒ식품의약품안전처
ⓒ식품의약품안전처
정부가 의료제품의 허가 심사를 혁신해 환자의 치료기회를 확대한다. 또 산업의 경쟁력이 되도록 규제도 혁신한다.
식품의약품안전처는 21일 이러한 내용을 담은 ‘2025년 주요정책 추진계획’을 공개했다. 계획에 따르면 신약은 자료심사, GMP 실사 등을 우선 실시해 허가기간을 420일에서 295일로 단축해 신속하게 허가·심사를 실시한다.
대면상담 횟수는 3회→10회로 늘려 투명성을 높이고 보완이 필요한 자료는 일부 보완되는 대로 먼저 검토하는 ‘수시검토 절차’를 신설한다.
의·약사 등 역량 높은 심사인력 비중을 현 31%에서 70% 목표로 지속 확대하고 최신기술 분야 교육프로그램 확충과 심사자의 경력단계별 맞춤형 교육(기본·핵심·심화)으로 심사인력의 전문성과 규제역량을 제고한다.
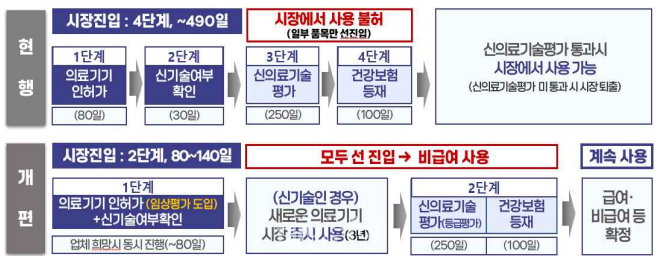
의료기기 허가와 신기술 확인절차를 동시 진행하고 의료기기 허가 후 신의료기술평가 등 별도 평가 없이 즉시 시장에 진입할 수 있게 된다.
신기술 의료기기의 안전성 강화를 위해 임상시험·경험·문헌 등을 종합적으로 검토하는 국제 수준의 임상평가 제도를 도입하고 디지털의료기기부터 모든 혁신 의료기기까지 확대 적용한다.
규제혁신 4.0을 추진해 미래산업 발전을 저해하는 ‘허들규제’를 과감히 개선하고 민생활력과 소외계층을 배려한 ‘민생체감형 규제’를 혁신한다.
세계 최초로 디지털 기술 적용 의료제품의 규제지원 법령체계를 정한 ‘디지털의료제품법’을 시행해 제품별 특성을 반영한 평가, 인력양성, 연구개발사업(R&D) 등 디지털의료제품의 상용화를 지원한다.
이 외에도 스마트한 대국민 행정서비스 제공 기반을 확대하고 안전에 혁신을 더하는 디지털 기반의 업무처리 방식을 개선할 예정이다.